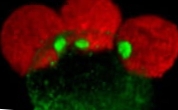
Neljapäev, 8. august 2013.- Teatud bakterid, näiteks 'Staphylococcus aureus', on võimelised kasutama väikseid noolemängu - bioloogilist relva, mis tapab peremeesraku selle membraani perforatsiooni teel. Šveitsis Lausanne'i föderaalse polütehnilise kooli (EPFL) teadlased on selle väikese masina tükkhaaval lahti võtnud ja leidnud komplekti valke, mis õigel ajal arenedes võrsuvad.
Ajakirjas „Nature Chemical Biology” avaldatud avastus pakub uusi vihjeid võitluses haigustekitajate vastu, mis on üha resistentsemad antibiootikumide suhtes. Peremeesraku ründamiseks peab relv kõigepealt ühenduma. Agressori mehhanism koosneb seitsmest valgust, mis voldivad enda ümber ja koonduvad ringis ning need pikad molekulid arenevad aja jooksul omamoodi kannus.
Päästik on lihtsalt masina veel üks osa, peptiid või väike orgaaniline molekul, mis peremeesorganismi ensüümidega kokkupuutel eraldub. Ristmiku tasakaal on reguleeritud: valgud saavad uue vormi, mis kipub ringikujuliseks liikuma, moodustades kanguse, mis seejärel ületab peremeesraku membraani.
Seda tüüpi bioloogiliste relvade keemiline reaktsioon ei ole seotud, kuid see on mehaaniline nähtus, ehkki molekulaarsel tasemel. Selle uuringu kaasautor Matteo Dal Peraro kasutab selle bakterite agressiivsuse tööriista tähistamiseks ka mõistet "nanomasin".
EPFL-i teadlased on töötanud 'Aeromonas hydrophila' - bakter, mis on rändurite seas tuntud soolehäirete tõttu tuntud bakter. Petri tassidel suutsid teadlased tahtlikult põhjustada nende noolekeste teket, paljastades seeläbi mikroorganismid seedeensüümide toimel ja suutsid täpselt modelleerida, kuidas iga valk dünaamiliselt ümber toimub, kui peptiidi pole, et moodustada kannus.
Teise autorite, Gisou Van der Gooti jaoks avab see avastus uusi terapeutilisi väljavaateid, näiteks nosokomiaalse stafülokoki nakkuse korral. "Võiksime ette kujutada asenduspeptiididega kaetud kateetrid, " ütleb ta. "See võiks ära hoida rõnga moodustumise ja seetõttu ka kannus. Soovime vältida palju nakkusi haiglates. "
Idee on käsitleda bakterite enda asemel relvastust, mis on eriti atraktiivne ajal, mil järjest suurem antibiootikumiresistentsus on üha tavalisem. "Selle lähenemisviisi eeliseks on see, et see ei põhjusta mutatsioone ja koos sellega ka patogeensete bakterite resistentsust, " võtab teadlane kokku.
Allikas:
Silte:
Perekond Ilu Ilu
Ajakirjas „Nature Chemical Biology” avaldatud avastus pakub uusi vihjeid võitluses haigustekitajate vastu, mis on üha resistentsemad antibiootikumide suhtes. Peremeesraku ründamiseks peab relv kõigepealt ühenduma. Agressori mehhanism koosneb seitsmest valgust, mis voldivad enda ümber ja koonduvad ringis ning need pikad molekulid arenevad aja jooksul omamoodi kannus.
Päästik on lihtsalt masina veel üks osa, peptiid või väike orgaaniline molekul, mis peremeesorganismi ensüümidega kokkupuutel eraldub. Ristmiku tasakaal on reguleeritud: valgud saavad uue vormi, mis kipub ringikujuliseks liikuma, moodustades kanguse, mis seejärel ületab peremeesraku membraani.
Seda tüüpi bioloogiliste relvade keemiline reaktsioon ei ole seotud, kuid see on mehaaniline nähtus, ehkki molekulaarsel tasemel. Selle uuringu kaasautor Matteo Dal Peraro kasutab selle bakterite agressiivsuse tööriista tähistamiseks ka mõistet "nanomasin".
EPFL-i teadlased on töötanud 'Aeromonas hydrophila' - bakter, mis on rändurite seas tuntud soolehäirete tõttu tuntud bakter. Petri tassidel suutsid teadlased tahtlikult põhjustada nende noolekeste teket, paljastades seeläbi mikroorganismid seedeensüümide toimel ja suutsid täpselt modelleerida, kuidas iga valk dünaamiliselt ümber toimub, kui peptiidi pole, et moodustada kannus.
Teise autorite, Gisou Van der Gooti jaoks avab see avastus uusi terapeutilisi väljavaateid, näiteks nosokomiaalse stafülokoki nakkuse korral. "Võiksime ette kujutada asenduspeptiididega kaetud kateetrid, " ütleb ta. "See võiks ära hoida rõnga moodustumise ja seetõttu ka kannus. Soovime vältida palju nakkusi haiglates. "
Idee on käsitleda bakterite enda asemel relvastust, mis on eriti atraktiivne ajal, mil järjest suurem antibiootikumiresistentsus on üha tavalisem. "Selle lähenemisviisi eeliseks on see, et see ei põhjusta mutatsioone ja koos sellega ka patogeensete bakterite resistentsust, " võtab teadlane kokku.
Allikas: