Teisipäev, 22. aprill 2014.- Kujutage ette, et arstid võiksid avada sügavkülmikud ja valida neerud, maksa või südame, mida kasutada päästeoperatsioonides. Järgnev selgitab, miks seda on nii raske saavutada.
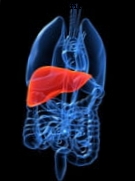
Kui vajate uut neeru, asendus südant või mõnda muud elutähtsat elundit, pole teil palju võimalusi. Selle põhjuseks on see, et kui tegemist on tervete inimelunditega siirdamistega, mis võivad päästa elusid, on pakkumise ja nõudluse vahel tohutu lõhe.
Ameerika Ühendriikides siirdati 2013. aastal 26 517 elundit, kuid ootejärjekorda on kantud enam kui 120 000 patsienti. Lihtsamalt öeldes pole kõigile piisavalt annetusi.
Veelgi hullem, mõnikord raisatakse olemasolevaid elundeid, kuna neil pole doonorilt eemaldatud palju säilivusaega.
Praegu on parim, mida me teha saame, hoida neid spetsiaalses lahuses, mis on temperatuuril 0 kraadi Celsiuse järgi veidi üle ühe või kahe päeva, mis ei võimalda palju aega patsientide leidmiseks, kellel on nende vastuvõtmiseks täiesti ühilduvad vastuvõtjad.
Kuid seal on võimalik vastus. Kui teadlased leiaksid viisi elundite külmutamiseks ja nende kahjustamata viimiseks tagasi, võiksime neid hoida nädalate või kuude jooksul.
Sama saaks teha laboris projekteeritud elunditega, kui suudame neid luua. Seda silmas pidades kavatseb Californias NASA teaduspargis asuva Singularity ülikooli laborite juurde kuuluv heategevusorganisatsioon Click Organ Preservation Alliance luua miljonäripreemia neile, kes julgustavad selles osas edusamme tegema.
Niisiis, kas saaksime vaadata hetke, mil siirdamiskirurgid avavad sügavkülmikud ja valivad neerud, maks või süda elupäästvate operatsioonide tegemiseks?
Teadlased on 40 aastat säilitanud või edukalt külmutanud inimrakkude väikseid rühmi.
Nad säilitavad rakke üle ujutavaid munarakke ja embrüoid niinimetatud krüoprotektiivsete ühendite lahustega, mis takistavad jääkristallide teket, mis võivad rakke hävitada, ning kaitsevad neid ka surmava kokkutõmbumise eest.
Kahjuks seisavad nad selle protsessi laiemas rakendamisel silmitsi suurte takistustega, kuna kõige keerukamate elundite ja kudede arhitektuur on jääkristallidega seotud kahjustuste suhtes palju haavatavam.
Väike rühm teadlasi pole siiski alla andnud ja valmistub väljakutseks osaliselt looduse vihjeid järgides.
Näiteks elavad Antarktika jääkalad väga külmas vees -2 kraadi kraadi juures tänu antifriisiproteiinidele (AFP), mis vähendavad nende kehavedelike külmumistemperatuuri ja seovad Jääkristallid selle leviku peatamiseks.
Teadlased on kasutanud Antarktika jääkalade AFP-sid sisaldavaid lahuseid, et säilitada roti südameid kuni 24 tunniks mõne kraadi alla nulli.
Kuid madalamal temperatuuril avaldavad selle looma AFP-des vastupidised tagajärjed: need sunnivad jääkristallide moodustumist moodustama teravaid punkte, mis läbistavad rakumembraane.
Veel üks kasulik külmumisvastane ühend, mis hiljuti avastati Alaska mardikas ja talub -60 ° C, võib olla kasulikum.
Kuid antifriisi koostisosad üksi ei hakka seda tööd tegema. Seda seetõttu, et külmutamine hävitab ka rakke, mõjutades vedelike voogu neisse ja välja.
Rakkudevahelistes ruumides moodustub jää, mis vähendab vedeliku mahtu ja suurendab lahustunud soolade ja muude ioonide kontsentratsiooni. Vesi tormab rakkudest välja, et seda kompenseerida, põhjustades nende närbumist ja surma.
Munarakkudes ja embrüodes on krüoprotektiivsed ühendid, näiteks glütserool, väga kasulikud: need mitte ainult ei tõrju vett välja, et vältida rakkudes jää tekkimist, vaid aitavad vältida ka raku kokkutõmbumist ja surma.
Probleem on selles, et need ühendid ei saa töötada sama võlujõuga organites. Ühelt poolt on koerakud jää tungimise suhtes palju vastuvõtlikumad.
Ja isegi kui rakud on kaitstud, hävitavad nendevahelistes ruumides moodustuvad jääkristallid rakuvälised struktuurid, mis hoiavad elundit koos ja hõlbustavad selle funktsiooni.
Üks võimalus jäätumisest tulenevatest ohtudest üle saada on selle tekkimise ärahoidmine. Sellepärast on mõned teadlased pühendunud klaasistamisele nimetatavale tehnikale, mille käigus kuded muutuvad nii külmaks, et neist saab jäävaba klaas.
Meetodit kasutatakse juba mõnes viljakuse kliinikus ja see on andnud keerukate kudede säilitamise osas seni kõige julgustavamaid tulemusi.
Näiteks 2000. aastal Mike Taylor ja tema kolleegid Cell and Tissue Systems'is Charlestonis, Lõuna-Carolinas, klaasistasid 5 cm pikkuseid küüliku veeni segmente, mis paiknevad rakkude ja elundite vahel keerukus ja näitasid, et pärast kuumutamist säilitavad nad suurema osa oma funktsioonist.
Kaks aastat hiljem tegid Greg Fahy ja tema kolleegid Californias asuvas külmsäilitamise uuringufirmas 21st-Century Medicine läbimurre: nad klaasistasid küüliku neeru, hoides seda allpool klaasistumistemperatuuri - Pärast sulatamist ja siirdamist küülikule, kes elas 48 päeva enne tapmist, et seda uurida, oli temperatuuril 122 kraadi Celsiuse järgi 10 minutit.
"See oli esimene kord, kui elutähtsat elundit koos hilisema elu toetamisega külmsäilitati ja siirdati, " ütleb Fahy. "See oli tõestus, et see oli realistlik ettepanek."
Kuid neer ei töötanud tervisliku versiooniga nii hästi, peamiselt seetõttu, et konkreetsel osal - medullal - kulus krüoprotektiivi lahuse imendumiseks kauem, mis tähendas, et sulatamise ajal tekkis sellele mingi jää.
"Ehkki olime meeleolukad, teadsime ka, et peame parandama, " lisab Fahy.
"See on lähim, kuhu oleme jõudnud, " ütleb Taylor, lisades hoiatava märkuse. "See oli rohkem kui 10 aastat tagasi ja kui tehnika oli piisavalt vastupidav, oleks pidanud olema aruandeid ja järeluuringuid, mis tõestaksid leiu olemasolu - seda polegi veel olemas olnud."
Fahy ütleb osaliselt, et areng on olnud aeglane, kuna see lakkas tootmast kemikaali, mis oli tema meetodi põhiosa. Tema grupp on siiski maa peal tagasi saanud ja edasi liikunud: Krüobioloogia Seltsi aastakoosolekul 2013. aastal esitles Fahy meetodit, mis võimaldab juhtmel kiiremini krüoprotektoreid laadida.
Hoolimata Fahy optimismist on selge, et suurte elundite säilitamisega seoses põhjustab klaasistamine mõnevõrra hirmuäratavaid väljakutseid. Alustuseks on vaja kõrgeid krüoprotektiivsete ainete kontsentratsioone (vähemalt viis korda suurem kui tavalise aeglase jahutamise korral), mis võivad mürgitada rakke ja kudesid, mida nad peaksid kaitsma.
Probleem süveneb suuremate kudede tõttu, kuna ühendite laadimiseks on vaja rohkem aega, mis tähendab aeglasemaid jahutusaegu ja suuremaid võimalusi toksiliseks kokkupuuteks. Lisaks, kui jahutus on liiga kiire või saavutab liiga madala temperatuuri, võivad tekkida praod.
See äärmiselt delikaatne kuumutamisprotsess kujutab endast rohkem takistusi. Kui klaasistatud proov ei kuumene kiiresti ega küllaltki ühtlaselt, annab klaasjasus võimaluse kristalliseerumiseks, protsessiks, mida nimetatakse devitrifikatsiooniks, ja võib jälle tekkida pragunemine.
(See) on väljakutse, millest me pole veel üle saanud, "ütleb Minnesota ülikooli kriobioloog ja insener John Bischof." Piirav tegur on kiirus ja ühetaolisus, mille abil saame selle sulatada. "Ja seda seetõttu, et Soojendamine toimub tavaliselt väljastpoolt sissepoole.
Eelmisel aastal pakkusid Bischof ja magistriõppe üliõpilane Michael Etheridge välja probleemi lahendamise viisi: lisage krüoprotektiivi lahusele magnetilisi nanoosakesi.
Idee on see, et osakesed hajuvad läbi koe ja kui nad on magnetväljadest erutunud, kuumutavad nad kõik kiiresti ja ühtlaselt. Praegu teeb duo koostööd Taylori ja tema kolleegidega, et testida meetodit küülikute arterites.
Enamasti on edusammud valdkonnas tehtud katse-eksituse meetodil: katsetades lahenduste kombinatsioone ning külmutamis- ja sulatamismeetodeid.
Kuid teadlased on hakanud kasutama ka uusi tehnoloogiaid, et uurida lähemalt, kuidas jää käitub rakkudes ja kudedes.
Kui protsesse mõistetakse üksikasjalikult, võib eeldada, et nende juhtimiseks on võimalik välja töötada uuenduslikud ja tõhusamad meetodid.
Viimase 12 kuu jooksul on selles valdkonnas tehtud olulisi edusamme. Pittsburghis Carnegie Melloni ülikooli mehaanikainsener Yoed Rabiniga töötav Taylor tutvustas uut seadet, mis võimaldab suure eraldusvõimega kangastel eraldada suure eraldusvõimega täisvärvilisi termopilte.
Vahepeal on Jens Karlsson Pennsylvania Villanova ülikoolist hõivanud hiljuti ülikiire aeglusega mikroskoopilisi videolõike sellest hetkest, kui jää siseneb kahe tihedalt seotud raku vahele väikestesse taskutesse ja põhjustab nendes kristalliseerumist.
Nende meetodite perspektiivid võiksid tuua uusi ideid, kuidas külmutamisprotsessis manipuleerida, ütles Karlsson, kes üritab välja mõelda, kuidas kudesid külmasäilitada pigem külmutamis- ja sulatamisprotsessi hoolika kontrolli all, mitte läbi klaasistamine.
Üks võimalus on geneetiliselt kujundada rakud, mida saab veenda moodustama raku-raku ühendusi, mis on vastupidavad külmsäilitamisele. Järgmine ülesanne oleks leida viis rakuvälise jää moodustumise suunamiseks nii, et see ei mõjuta elundi funktsiooni.
Samuti on Karlsson nõus miljonite võimalike protokollide tõhusaks testimiseks külmutamisprotsessi arvutisimulatsioone.
"Vajame edasiliikumise kiirendamiseks seda tüüpi vahendeid, " ütleb Karlsson, kes võrdleb ülesannet sellega, et "üritatakse jõuda kuule murdosa vahenditega sellele pingutusele eraldatud vahenditest".
Isegi piiratud ressurssidega on piirkond näidanud, et jäävaba krüosäilitus on väikeste kudede, näiteks veresoonte segmendi jaoks praktiline. "Tõke, mis jääb ja mis on oluline, " ütleb Taylor, "on selle skaleerimine inimese orelile."
Karlssoni jaoks, kes kahtlustab, et sellised jõupingutused võivad "seina põrkuda" enne, kui klaasistamine kunagi inimorganeid teenib, kujutavad külmumismeetodid (või need, mida ta nimetab jääpõhisteks meetoditeks) võrdset või isegi teed Usaldusväärsem edu suhtes.
Kuid on veel üks viimane mõte, mida tuleb tõsiselt võtta. "Ükski külmsäilitamise tehnika ei paku komponentrakkude 100% -list püsimist, " ütleb Taylor.
"Paljudes rakendustes võib seda lubada, kuid ühe organi jaoks võib see tähendada märkimisväärset vigastuste taset pärast ladustamist või siirdamist."
Lõppkokkuvõttes tähendab see, et hoolimata sellest, kui hästi isendid on külmsäilitatud, on need tõenäoliselt halvema kvaliteediga võrreldes värskelt omandatud elunditega.
Allikas:
Silte:
Väljaregistreerimisel Ilu Dieet-Ja Toitumise
Kui vajate uut neeru, asendus südant või mõnda muud elutähtsat elundit, pole teil palju võimalusi. Selle põhjuseks on see, et kui tegemist on tervete inimelunditega siirdamistega, mis võivad päästa elusid, on pakkumise ja nõudluse vahel tohutu lõhe.
Ameerika Ühendriikides siirdati 2013. aastal 26 517 elundit, kuid ootejärjekorda on kantud enam kui 120 000 patsienti. Lihtsamalt öeldes pole kõigile piisavalt annetusi.
Veelgi hullem, mõnikord raisatakse olemasolevaid elundeid, kuna neil pole doonorilt eemaldatud palju säilivusaega.
Praegu on parim, mida me teha saame, hoida neid spetsiaalses lahuses, mis on temperatuuril 0 kraadi Celsiuse järgi veidi üle ühe või kahe päeva, mis ei võimalda palju aega patsientide leidmiseks, kellel on nende vastuvõtmiseks täiesti ühilduvad vastuvõtjad.
Kuid seal on võimalik vastus. Kui teadlased leiaksid viisi elundite külmutamiseks ja nende kahjustamata viimiseks tagasi, võiksime neid hoida nädalate või kuude jooksul.
Sama saaks teha laboris projekteeritud elunditega, kui suudame neid luua. Seda silmas pidades kavatseb Californias NASA teaduspargis asuva Singularity ülikooli laborite juurde kuuluv heategevusorganisatsioon Click Organ Preservation Alliance luua miljonäripreemia neile, kes julgustavad selles osas edusamme tegema.
Kas on võimalik külmsäilitada?
Niisiis, kas saaksime vaadata hetke, mil siirdamiskirurgid avavad sügavkülmikud ja valivad neerud, maks või süda elupäästvate operatsioonide tegemiseks?
Teadlased on 40 aastat säilitanud või edukalt külmutanud inimrakkude väikseid rühmi.
Nad säilitavad rakke üle ujutavaid munarakke ja embrüoid niinimetatud krüoprotektiivsete ühendite lahustega, mis takistavad jääkristallide teket, mis võivad rakke hävitada, ning kaitsevad neid ka surmava kokkutõmbumise eest.
Kahjuks seisavad nad selle protsessi laiemas rakendamisel silmitsi suurte takistustega, kuna kõige keerukamate elundite ja kudede arhitektuur on jääkristallidega seotud kahjustuste suhtes palju haavatavam.
Väike rühm teadlasi pole siiski alla andnud ja valmistub väljakutseks osaliselt looduse vihjeid järgides.
Näiteks elavad Antarktika jääkalad väga külmas vees -2 kraadi kraadi juures tänu antifriisiproteiinidele (AFP), mis vähendavad nende kehavedelike külmumistemperatuuri ja seovad Jääkristallid selle leviku peatamiseks.
Teadlased on kasutanud Antarktika jääkalade AFP-sid sisaldavaid lahuseid, et säilitada roti südameid kuni 24 tunniks mõne kraadi alla nulli.
Kuid madalamal temperatuuril avaldavad selle looma AFP-des vastupidised tagajärjed: need sunnivad jääkristallide moodustumist moodustama teravaid punkte, mis läbistavad rakumembraane.
Veel üks kasulik külmumisvastane ühend, mis hiljuti avastati Alaska mardikas ja talub -60 ° C, võib olla kasulikum.
Kuid antifriisi koostisosad üksi ei hakka seda tööd tegema. Seda seetõttu, et külmutamine hävitab ka rakke, mõjutades vedelike voogu neisse ja välja.
Rakkudevahelistes ruumides moodustub jää, mis vähendab vedeliku mahtu ja suurendab lahustunud soolade ja muude ioonide kontsentratsiooni. Vesi tormab rakkudest välja, et seda kompenseerida, põhjustades nende närbumist ja surma.
Munarakkudes ja embrüodes on krüoprotektiivsed ühendid, näiteks glütserool, väga kasulikud: need mitte ainult ei tõrju vett välja, et vältida rakkudes jää tekkimist, vaid aitavad vältida ka raku kokkutõmbumist ja surma.
Probleem on selles, et need ühendid ei saa töötada sama võlujõuga organites. Ühelt poolt on koerakud jää tungimise suhtes palju vastuvõtlikumad.
Ja isegi kui rakud on kaitstud, hävitavad nendevahelistes ruumides moodustuvad jääkristallid rakuvälised struktuurid, mis hoiavad elundit koos ja hõlbustavad selle funktsiooni.
Vitrifikatsioon
Üks võimalus jäätumisest tulenevatest ohtudest üle saada on selle tekkimise ärahoidmine. Sellepärast on mõned teadlased pühendunud klaasistamisele nimetatavale tehnikale, mille käigus kuded muutuvad nii külmaks, et neist saab jäävaba klaas.
Meetodit kasutatakse juba mõnes viljakuse kliinikus ja see on andnud keerukate kudede säilitamise osas seni kõige julgustavamaid tulemusi.
Näiteks 2000. aastal Mike Taylor ja tema kolleegid Cell and Tissue Systems'is Charlestonis, Lõuna-Carolinas, klaasistasid 5 cm pikkuseid küüliku veeni segmente, mis paiknevad rakkude ja elundite vahel keerukus ja näitasid, et pärast kuumutamist säilitavad nad suurema osa oma funktsioonist.
Kaks aastat hiljem tegid Greg Fahy ja tema kolleegid Californias asuvas külmsäilitamise uuringufirmas 21st-Century Medicine läbimurre: nad klaasistasid küüliku neeru, hoides seda allpool klaasistumistemperatuuri - Pärast sulatamist ja siirdamist küülikule, kes elas 48 päeva enne tapmist, et seda uurida, oli temperatuuril 122 kraadi Celsiuse järgi 10 minutit.
"See oli esimene kord, kui elutähtsat elundit koos hilisema elu toetamisega külmsäilitati ja siirdati, " ütleb Fahy. "See oli tõestus, et see oli realistlik ettepanek."
Kuid neer ei töötanud tervisliku versiooniga nii hästi, peamiselt seetõttu, et konkreetsel osal - medullal - kulus krüoprotektiivi lahuse imendumiseks kauem, mis tähendas, et sulatamise ajal tekkis sellele mingi jää.
"Ehkki olime meeleolukad, teadsime ka, et peame parandama, " lisab Fahy.
"See on lähim, kuhu oleme jõudnud, " ütleb Taylor, lisades hoiatava märkuse. "See oli rohkem kui 10 aastat tagasi ja kui tehnika oli piisavalt vastupidav, oleks pidanud olema aruandeid ja järeluuringuid, mis tõestaksid leiu olemasolu - seda polegi veel olemas olnud."
Fahy ütleb osaliselt, et areng on olnud aeglane, kuna see lakkas tootmast kemikaali, mis oli tema meetodi põhiosa. Tema grupp on siiski maa peal tagasi saanud ja edasi liikunud: Krüobioloogia Seltsi aastakoosolekul 2013. aastal esitles Fahy meetodit, mis võimaldab juhtmel kiiremini krüoprotektoreid laadida.
Hoolimata Fahy optimismist on selge, et suurte elundite säilitamisega seoses põhjustab klaasistamine mõnevõrra hirmuäratavaid väljakutseid. Alustuseks on vaja kõrgeid krüoprotektiivsete ainete kontsentratsioone (vähemalt viis korda suurem kui tavalise aeglase jahutamise korral), mis võivad mürgitada rakke ja kudesid, mida nad peaksid kaitsma.
Probleem süveneb suuremate kudede tõttu, kuna ühendite laadimiseks on vaja rohkem aega, mis tähendab aeglasemaid jahutusaegu ja suuremaid võimalusi toksiliseks kokkupuuteks. Lisaks, kui jahutus on liiga kiire või saavutab liiga madala temperatuuri, võivad tekkida praod.
See äärmiselt delikaatne kuumutamisprotsess kujutab endast rohkem takistusi. Kui klaasistatud proov ei kuumene kiiresti ega küllaltki ühtlaselt, annab klaasjasus võimaluse kristalliseerumiseks, protsessiks, mida nimetatakse devitrifikatsiooniks, ja võib jälle tekkida pragunemine.
(See) on väljakutse, millest me pole veel üle saanud, "ütleb Minnesota ülikooli kriobioloog ja insener John Bischof." Piirav tegur on kiirus ja ühetaolisus, mille abil saame selle sulatada. "Ja seda seetõttu, et Soojendamine toimub tavaliselt väljastpoolt sissepoole.
Eelmisel aastal pakkusid Bischof ja magistriõppe üliõpilane Michael Etheridge välja probleemi lahendamise viisi: lisage krüoprotektiivi lahusele magnetilisi nanoosakesi.
Idee on see, et osakesed hajuvad läbi koe ja kui nad on magnetväljadest erutunud, kuumutavad nad kõik kiiresti ja ühtlaselt. Praegu teeb duo koostööd Taylori ja tema kolleegidega, et testida meetodit küülikute arterites.
Jää tegevuses
Enamasti on edusammud valdkonnas tehtud katse-eksituse meetodil: katsetades lahenduste kombinatsioone ning külmutamis- ja sulatamismeetodeid.
Kuid teadlased on hakanud kasutama ka uusi tehnoloogiaid, et uurida lähemalt, kuidas jää käitub rakkudes ja kudedes.
Kui protsesse mõistetakse üksikasjalikult, võib eeldada, et nende juhtimiseks on võimalik välja töötada uuenduslikud ja tõhusamad meetodid.
Viimase 12 kuu jooksul on selles valdkonnas tehtud olulisi edusamme. Pittsburghis Carnegie Melloni ülikooli mehaanikainsener Yoed Rabiniga töötav Taylor tutvustas uut seadet, mis võimaldab suure eraldusvõimega kangastel eraldada suure eraldusvõimega täisvärvilisi termopilte.
Vahepeal on Jens Karlsson Pennsylvania Villanova ülikoolist hõivanud hiljuti ülikiire aeglusega mikroskoopilisi videolõike sellest hetkest, kui jää siseneb kahe tihedalt seotud raku vahele väikestesse taskutesse ja põhjustab nendes kristalliseerumist.
Nende meetodite perspektiivid võiksid tuua uusi ideid, kuidas külmutamisprotsessis manipuleerida, ütles Karlsson, kes üritab välja mõelda, kuidas kudesid külmasäilitada pigem külmutamis- ja sulatamisprotsessi hoolika kontrolli all, mitte läbi klaasistamine.
Üks võimalus on geneetiliselt kujundada rakud, mida saab veenda moodustama raku-raku ühendusi, mis on vastupidavad külmsäilitamisele. Järgmine ülesanne oleks leida viis rakuvälise jää moodustumise suunamiseks nii, et see ei mõjuta elundi funktsiooni.
Samuti on Karlsson nõus miljonite võimalike protokollide tõhusaks testimiseks külmutamisprotsessi arvutisimulatsioone.
"Vajame edasiliikumise kiirendamiseks seda tüüpi vahendeid, " ütleb Karlsson, kes võrdleb ülesannet sellega, et "üritatakse jõuda kuule murdosa vahenditega sellele pingutusele eraldatud vahenditest".
Isegi piiratud ressurssidega on piirkond näidanud, et jäävaba krüosäilitus on väikeste kudede, näiteks veresoonte segmendi jaoks praktiline. "Tõke, mis jääb ja mis on oluline, " ütleb Taylor, "on selle skaleerimine inimese orelile."
Karlssoni jaoks, kes kahtlustab, et sellised jõupingutused võivad "seina põrkuda" enne, kui klaasistamine kunagi inimorganeid teenib, kujutavad külmumismeetodid (või need, mida ta nimetab jääpõhisteks meetoditeks) võrdset või isegi teed Usaldusväärsem edu suhtes.
Kuid on veel üks viimane mõte, mida tuleb tõsiselt võtta. "Ükski külmsäilitamise tehnika ei paku komponentrakkude 100% -list püsimist, " ütleb Taylor.
"Paljudes rakendustes võib seda lubada, kuid ühe organi jaoks võib see tähendada märkimisväärset vigastuste taset pärast ladustamist või siirdamist."
Lõppkokkuvõttes tähendab see, et hoolimata sellest, kui hästi isendid on külmsäilitatud, on need tõenäoliselt halvema kvaliteediga võrreldes värskelt omandatud elunditega.
Allikas: