Teisipäev, 2. aprill 2013.- Rahvusvaheline teadlaste meeskond on esimest korda kaardistanud telomeraasi, ensüümi, mis on võimeline looma uusi kromosoomide otsteid, nimetatakse raku telomeerideks ehk ensüümiks, millel on vananemisele omamoodi noorendav toime. Tavaline mobiiltelefon, vastavalt uuringu tulemustele, mis avaldati ajakirjas „Nature Genetics” ja mis on samm edasi võitluses vähi vastu.
"Noorte rakulise allika", telomeraasi, kaardistamine on üks olulise uurimisprojekti tulemusi, milles osales rohkem kui tuhat teadlast kogu maailmast nelja aasta vältel kestnud rasket tööd tehes rohkem kui vereproovidega 200 000 inimest Selle autorite sõnul on see suurim vähiprobleemide valdkonnas läbi viidud koostööprojekt.
Kopenhaageni ülikooli tervise- ja arstiteaduskonna teadur ning Kopenhaageni ülikooli haigla Herlevis asuva Kopenhaageni kliinilise biokeemia osakonna personaalspetsialist Stig E. Bojesen juhtis telomeraasi süstematiseerimise püüdlusi. "Oleme avastanud, et telomeerse geeni erinevused on seotud nii erinevat tüüpi vähktõve riski kui ka telomeeride pikkusega, " ütleb ta.
Tema arvates oli "üllatav" tõdemus, et haigusi põhjustavad variandid ei olnud samad, mis on muutnud telomeeride pikkust. "See näitab, et telomeraas mängib palju keerukamat rolli, kui seni arvati, " lisab Stig E. Bojesen.
Telomeraasi kaardistamine on oluline avastus, kuna telomeraas on rakubioloogia üks põhilisemaid ensüüme ja pikendab telomeeride pikkust, et nad saaksid sama pikkuse kui enne rakkude jagunemist. Telomeraasi kaardistamine võib muu hulgas suurendada teadlikkust vähist ja selle ravist, samuti illustreerida vähi ja telomeeri pikkuse vahelise geneetilise seose uusi tulemusi, kirjutab Bojesen.
Inimkeha koosneb viiskümmend miljardit rakku ja igas rakus on 46 kromosoomi, mis on tuuma struktuurid, mis sisaldavad meie pärilikku materjali, DNA. Kõigi kromosoomide otsad on kaitstud nn telomeeridega, mis kaitsevad kromosoome nagu kingapaela otsas olev plastkest. Kuid iga kord, kui rakk jaguneb, muutuvad telomeerid pisut lühemaks ja muutuvad kromosoomide kaitsmiseks liiga lühikeseks.
Mõned kehas asuvad spetsiaalsed rakud võivad aktiveerida telomeraasi, mis võib omakorda pikendada telomeere. Sugurakkudel või muudel tüvirakkudel, mis peavad suutma normaalseid rakke rohkem jaotada, on see omadus olemas, kuid kahjuks on vähirakud triki avastanud ja teatavasti toodavad nad ka telomeraasi ning jäävad seetõttu kunstlikult nooreks.
Telomeraasi geenil on seetõttu oluline roll vähibioloogias ja teadlased arvavad, et just vähigeenide identifitseerimise abil saab tuvastamise määra ja ravi parendada.
"Meie tulemused on väga üllatavad ja osutavad mitmes suunas. Kuid nagu kõigi heade uuringute puhul, pakub meie töö palju vastuseid, kuid jätab rohkem küsimusi, " järeldab Stig E. Bojesen.
Selle laiaulatusliku koostöö tulemuseks on 14 artiklit, mis avaldatakse samaaegselt: kuus neist on samas ajakirja “Loodusgeneetika” väljaandes ja ülejäänud kaheksa muudes ajakirjades. Projekti kaasatud paljude teadlaste artiklid keskenduvad keskkonna, geneetika ja vähi, eriti rinnavähi, munasarjavähi ja eesnäärmevähi seostele.
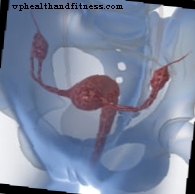
Nii on see teadlaste rahvusvaheline koostöö avastanud inimese genoomi viis uut piirkonda, mis on seotud suurenenud munasarjavähi tekkeriskiga, mille tulemused on avaldatud neljas uuringus, kahes ajakirjas Nature Communications ja kahes ajakirjas Nature Geneetics. Selleks analüüsiti enam kui 40 000 naise geneetilist teavet.
Teadustöö avaldatakse geenikeskkonna onkoloogiaalase koostöö uuringute (COG) uute andmete kooskõlastatud avaldamise osana, mis on rahvusvaheline teaduskoostöö, milles osalevad teadlased Euroopast, Aasiast, Austraaliast ja Põhja-Ameerikast, et tuvastada geneetilisi variatsioone mis muudavad teatud inimesed vastuvõtlikuks rinna-, eesnäärme- ja munasarjavähi tekkele.
Päritud mutatsioonid geenides BRCA1 ja BRCA2 suurendavad dramaatiliselt munasarjavähi riski. BRCA1 ja BRCA2 geneetiline test võib tuvastada naisi, kellele tuleks rohkem kasu munasarjavähi ennetamise operatsioonidest, kuid see on oluline vähem kui 1 protsendi elanikkonna jaoks.
Munasarjade riski võivad mõjutada ka muud sagedamini esinevad geneetilised variandid. Munasarjavähiliidu konsortsium on varem kirjeldanud kuut geneetilist erinevust ja nüüd on COG-projekt leidnud veel viis.
Teisest küljest on Ühendkuningriigi Yorki ülikooli teadlased avastanud eesnäärmevähi arengu tõukejõu. Tema uurimistöös, mis avaldati ajakirjas Nature Communications ja mida rahastas heategevusorganisatsioon Yorkshire Cancer Research, selgub DNA olemasolu, mis indutseerib vähki, et viia inimese eesnäärmevähist ekstraheeritud tüvirakud ümber.
See avab tee tüvirakkudele suunatud ravimite väljatöötamiseks, mis viib tõhusamate ravimeetoditeni, mis toimivad haiguse põhjustaja vastu. Kui praegused ravimeetodid võivad teisi vähirakke hävitada, suudavad tüvirakud nende mõju vältida, põhjustades vähi kordumist, kuid see meeskond uuris täpseid molekulaarseid omadusi, mis võimaldavad neil rakkudel levida, ellu jääda ja vastu panna agressiivne ravi, näiteks kiiritus ja keemiaravi.
"Verevähkide, näiteks leukeemia korral, toimub DNA ümberkorraldamine kromosomaalse translokatsioonina tuntud sündmuse ajal, mille tulemuseks on mutantse valgu sisaldus, mis juhib vähi progresseerumist. Ehkki hiljuti on sarnaseid ümberkorraldusi avastatud ka tahke vähi korral, , pole teada, kuidas rakufunktsioonid tulenevad. Meie töö on selle idee vaidlustanud, "selgitab YCR-i vähiuuringute üksuse direktor professor Norman Maitland.
Professor Maitlandi ülikooli bioloogiaosakonna meeskond on leidnud need eesnäärmevähi tüvirakkude geneetilised õnnetused ja näidanud, et need viivad rakkudes spetsiifilise vähiga seotud geeni, mida nimetatakse ERG-le, sobimatuks aktiveerimiseks. . Arvatakse, et see aktiveerimine põhjustab tüvirakkude sagedasemat uuenemist.
Allikas:
Silte:
Ravimid Regeneratsioon Väljaregistreerimisel
"Noorte rakulise allika", telomeraasi, kaardistamine on üks olulise uurimisprojekti tulemusi, milles osales rohkem kui tuhat teadlast kogu maailmast nelja aasta vältel kestnud rasket tööd tehes rohkem kui vereproovidega 200 000 inimest Selle autorite sõnul on see suurim vähiprobleemide valdkonnas läbi viidud koostööprojekt.
Kopenhaageni ülikooli tervise- ja arstiteaduskonna teadur ning Kopenhaageni ülikooli haigla Herlevis asuva Kopenhaageni kliinilise biokeemia osakonna personaalspetsialist Stig E. Bojesen juhtis telomeraasi süstematiseerimise püüdlusi. "Oleme avastanud, et telomeerse geeni erinevused on seotud nii erinevat tüüpi vähktõve riski kui ka telomeeride pikkusega, " ütleb ta.
Tema arvates oli "üllatav" tõdemus, et haigusi põhjustavad variandid ei olnud samad, mis on muutnud telomeeride pikkust. "See näitab, et telomeraas mängib palju keerukamat rolli, kui seni arvati, " lisab Stig E. Bojesen.
Telomeraasi kaardistamine on oluline avastus, kuna telomeraas on rakubioloogia üks põhilisemaid ensüüme ja pikendab telomeeride pikkust, et nad saaksid sama pikkuse kui enne rakkude jagunemist. Telomeraasi kaardistamine võib muu hulgas suurendada teadlikkust vähist ja selle ravist, samuti illustreerida vähi ja telomeeri pikkuse vahelise geneetilise seose uusi tulemusi, kirjutab Bojesen.
Inimkeha koosneb viiskümmend miljardit rakku ja igas rakus on 46 kromosoomi, mis on tuuma struktuurid, mis sisaldavad meie pärilikku materjali, DNA. Kõigi kromosoomide otsad on kaitstud nn telomeeridega, mis kaitsevad kromosoome nagu kingapaela otsas olev plastkest. Kuid iga kord, kui rakk jaguneb, muutuvad telomeerid pisut lühemaks ja muutuvad kromosoomide kaitsmiseks liiga lühikeseks.
Mõned kehas asuvad spetsiaalsed rakud võivad aktiveerida telomeraasi, mis võib omakorda pikendada telomeere. Sugurakkudel või muudel tüvirakkudel, mis peavad suutma normaalseid rakke rohkem jaotada, on see omadus olemas, kuid kahjuks on vähirakud triki avastanud ja teatavasti toodavad nad ka telomeraasi ning jäävad seetõttu kunstlikult nooreks.
Telomeraasi geenil on seetõttu oluline roll vähibioloogias ja teadlased arvavad, et just vähigeenide identifitseerimise abil saab tuvastamise määra ja ravi parendada.
"Meie tulemused on väga üllatavad ja osutavad mitmes suunas. Kuid nagu kõigi heade uuringute puhul, pakub meie töö palju vastuseid, kuid jätab rohkem küsimusi, " järeldab Stig E. Bojesen.
Selle laiaulatusliku koostöö tulemuseks on 14 artiklit, mis avaldatakse samaaegselt: kuus neist on samas ajakirja “Loodusgeneetika” väljaandes ja ülejäänud kaheksa muudes ajakirjades. Projekti kaasatud paljude teadlaste artiklid keskenduvad keskkonna, geneetika ja vähi, eriti rinnavähi, munasarjavähi ja eesnäärmevähi seostele.
ROHKEM GENEETILISED VARIANTID Munasarjavähi jaoks
Nii on see teadlaste rahvusvaheline koostöö avastanud inimese genoomi viis uut piirkonda, mis on seotud suurenenud munasarjavähi tekkeriskiga, mille tulemused on avaldatud neljas uuringus, kahes ajakirjas Nature Communications ja kahes ajakirjas Nature Geneetics. Selleks analüüsiti enam kui 40 000 naise geneetilist teavet.
Teadustöö avaldatakse geenikeskkonna onkoloogiaalase koostöö uuringute (COG) uute andmete kooskõlastatud avaldamise osana, mis on rahvusvaheline teaduskoostöö, milles osalevad teadlased Euroopast, Aasiast, Austraaliast ja Põhja-Ameerikast, et tuvastada geneetilisi variatsioone mis muudavad teatud inimesed vastuvõtlikuks rinna-, eesnäärme- ja munasarjavähi tekkele.
Päritud mutatsioonid geenides BRCA1 ja BRCA2 suurendavad dramaatiliselt munasarjavähi riski. BRCA1 ja BRCA2 geneetiline test võib tuvastada naisi, kellele tuleks rohkem kasu munasarjavähi ennetamise operatsioonidest, kuid see on oluline vähem kui 1 protsendi elanikkonna jaoks.
Munasarjade riski võivad mõjutada ka muud sagedamini esinevad geneetilised variandid. Munasarjavähiliidu konsortsium on varem kirjeldanud kuut geneetilist erinevust ja nüüd on COG-projekt leidnud veel viis.
Teisest küljest on Ühendkuningriigi Yorki ülikooli teadlased avastanud eesnäärmevähi arengu tõukejõu. Tema uurimistöös, mis avaldati ajakirjas Nature Communications ja mida rahastas heategevusorganisatsioon Yorkshire Cancer Research, selgub DNA olemasolu, mis indutseerib vähki, et viia inimese eesnäärmevähist ekstraheeritud tüvirakud ümber.
See avab tee tüvirakkudele suunatud ravimite väljatöötamiseks, mis viib tõhusamate ravimeetoditeni, mis toimivad haiguse põhjustaja vastu. Kui praegused ravimeetodid võivad teisi vähirakke hävitada, suudavad tüvirakud nende mõju vältida, põhjustades vähi kordumist, kuid see meeskond uuris täpseid molekulaarseid omadusi, mis võimaldavad neil rakkudel levida, ellu jääda ja vastu panna agressiivne ravi, näiteks kiiritus ja keemiaravi.
"Verevähkide, näiteks leukeemia korral, toimub DNA ümberkorraldamine kromosomaalse translokatsioonina tuntud sündmuse ajal, mille tulemuseks on mutantse valgu sisaldus, mis juhib vähi progresseerumist. Ehkki hiljuti on sarnaseid ümberkorraldusi avastatud ka tahke vähi korral, , pole teada, kuidas rakufunktsioonid tulenevad. Meie töö on selle idee vaidlustanud, "selgitab YCR-i vähiuuringute üksuse direktor professor Norman Maitland.
Professor Maitlandi ülikooli bioloogiaosakonna meeskond on leidnud need eesnäärmevähi tüvirakkude geneetilised õnnetused ja näidanud, et need viivad rakkudes spetsiifilise vähiga seotud geeni, mida nimetatakse ERG-le, sobimatuks aktiveerimiseks. . Arvatakse, et see aktiveerimine põhjustab tüvirakkude sagedasemat uuenemist.
Allikas:













-budowa-i-funkcje.jpg)